国家医药管理局医药工业洁净厂房设计规范国家医药管理局医药工业洁净厂房设计规范国家医药管理局医药工业洁净厂房设计规范主编单位:国家医药管理局上海医药设计院审批部门:国家医药管理局实施日期:1997年1月1日。该制剂说明书是为我国医药行业深入实施GMP,为满足制药行业洁净厂房建设的需要,GMP专业组,国家医药管理局GSP委员会决定组织编写《医药工业洁净厂房设计规范》。
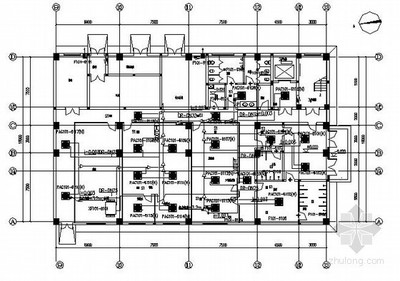
1、你好,你知道在车间里面的关于医药洁净室(区
5.1.4医用洁净室(区)的布局应符合下列要求:1。在满足生产工艺和噪声水平要求的前提下,空气洁净度等级较高的医用洁净室(区)宜布置在空调机房附近,空气洁净度等级相同的工序和医用洁净室(区)的布置应相对集中。2、不同空气洁净度等级的医用洁净室(区)之间的人员通道和物料传递,应有防污染措施。5.1.5与生产规模相适应的原辅材料、半成品、成品的储存区应设置在制药工业洁净车间的生产区附近。

不合格产品应存放在特殊区域。5.1.6青霉素等高度致敏药物的生产车间应独立设置。避孕药品、卡介苗和结核菌素的生产车间必须与其他药品的生产车间分开设置。5.1.7下列药品生产区域必须单独布置:1。β-内酰胺类药物生产区和其他生产区。2.中药材预处理、提取、浓缩生产区和制剂生产区。3、动物器官、组织清洗或加工生产区及其制剂生产区。
2、打算新建干细胞制备车间,从规划设计开始应遵循哪些标准?
简单来说,干细胞是一类具有无限或永恒自我更新能力的细胞,能够产生至少一类高度分化的子细胞。多年来,干细胞的定义不断被修改,从不同的层面被定义。目前,大多数生物学家和医学家认为,干细胞是一种来源于胚胎、胎儿或成人,在一定条件下具有无限自我更新、增殖和分化能力的细胞。它们可以产生与自身具有相同表型和基因型的子细胞,即构成组织和器官的特化细胞,并分化为祖细胞。

干细胞群的功能是控制和维持细胞再生。一般来说,干细胞与其终末分化的子代细胞之间存在被称为“定向祖细胞”的中间祖细胞,其扩增能力有限,分化潜能有限。这些细胞群的功能是增加干细胞每次分裂后产生的分化细胞的数量。干细胞有自我更新的能力,但干细胞的分裂其实是相对不对称的。虽然干细胞的结构意义可以帮助在形态学和分子生物学的水平上定义干细胞,但是干细胞的定义仍然必须基于功能性。

3、医药洁净室的温度跟湿度有什么标准规定吗?
有三个标准可供参考:1)GB《医药工业洁净厂房设计规范》,100级,温度20~24℃,湿度45 ~ 60%;10000级,温度20~24℃,湿度45 ~ 60%;等级,温度18~26℃,湿度45 ~ 65%;等级,温度18~26℃,湿度45 ~ 65%;2)中国药典(第四部,2015年版)A ~D级:温度18~26℃,湿度45 ~ 65%;

4、什么是洁净厂房?洁净厂房是干什么用的?
国家医药管理局《医药工业洁净厂房设计规范》国家医药管理局《医药工业洁净厂房设计规范》国家医药管理局《医药工业洁净厂房设计规范》主编单位:国家医药管理局上海医药设计院审批部门:国家医药管理局实施日期:1997年1月1日《中国医药工业深入实施GMP的准备说明》为适应医药工业洁净厂房建设的需要,GMP专业组,国家医药管理局GSP委员会决定组织编写《医药工业洁净厂房设计规范》。

一般来说:1.0.1洁净厂房的设计必须技术先进、经济适用、安全可靠、保证质量,并符合节能、劳动卫生和环境保护的要求。1.0.2本规范适用于新建、扩建和改建的洁净厂房的设计。1.0.3洁净厂房的设计应为建造、安装、维护和管理、检修和测试以及安全运行创造必要的条件。1.0.4洁净厂房的设计除按本规范执行外,还应符合现行的相关强制性国家标准和规范。

5、医药工业厂房的风管跟附件有什么要求?
SICOLAB整理制药工业厂房的风管及附件应符合下列要求:1。风管的截面尺寸应满足清洗内壁的要求,并设置清洗口。风管应采用不易脱落颗粒物、不易生锈、不易消毒的材料制成。二、洁净空调系统应根据需要设置电动密封阀、风量控制阀、防火阀、止回阀等附件,医疗洁净室(区)的送、回风管段,应设置风量控制阀。3.在下列情况下,通风和洁净空调系统的风管应安装防火阀:1。风管穿过防火分区内的隔墙和变形缝内的防火隔墙两侧。

3垂直风管与每层水平风管在水平段上的交接。4当水平风管和垂直风管位于不同的防火分区时,水平风管和垂直风管的连接处。四、风管穿过使用易燃易爆介质的生产区域的隔墙或防爆隔墙时,应设置防火阀和止回阀。五、医药洁净室(区)空调系统的风管和调节阀,以及高效空气过滤器的保护网、孔板和扩散孔板等附件的制作材料和涂层,应根据输送空气的洁净度等级和空气环境条件确定。

6、gmp车间,医疗器械厂房整体设计施工建造需要多少钱
gmp车间,医疗器械车间的整体设计、施工、建设费用是多少?具体数字只能根据地区和要求来计算。以下是相关资料,希望对你有帮助。《体外诊断试剂生产细则(试行)》已实施近两年,无菌和植入性医疗器械生产质量体系管理规范将于2011年实施。日常监管中发现部分企业洁净室建设不规范。为此,对洁净厂房的建设提出如下要求:1。目前涉及的标准和工作文件。YY00332000无菌医疗器械生产管理规范;2.YY/T0567.12005医疗产品的无菌加工第1部分:一般要求;3.YY/T0567.22005医疗产品的无菌加工第2部分过滤;4.GB《医药工业洁净厂房设计规范》;5.体外诊断试剂生产细则(试行)附录A;6.关于印发《无菌医疗器械实施细则和检验评价标准(试行)》(美国食品药品监督管理局机械厂设计标准规范)的通知:1 .工业厂房的设计必须贯彻国家有关方针政策,做到技术先进、经济合理、安全适用、保证质量、符合节能环保要求。二、本规范适用于新建、改建、扩建工业厂房的设计,但不适用于以细菌为控制对象的生物洁净室。本规范中关于防火、疏散和消防设施的规定不适用于建筑高度超过24米的高层工业厂房和地下工业厂房的设计。
7、工业厂房设计规范有哪些
工业厂房的设计除了遵循建筑设计规范外,还要遵循以下原则:1。工业厂房的建设首先要按照不同行业的工艺专业的建筑规划来进行,比如主厂房周围的附属建筑,其功能服从于专业工业厂房中生产过程的走向。原料仓库不能建在生产过程结束的厂房里,成品仓库也是一样,也就是说,工业厂房要经过专业的工艺总图规划。2.车间的面积不仅关系到产品的年产量,还直接关系到生产过程中的设备、半成品储存、运输通道、设备维修间、生产管理、人员劳动卫生等辅助用房的面积。
